Mind a kémiai vegyületek mivel a kémiai elemek molekulákból állnak, és ezek viszont atomokból állnak. Az atomok egységesek maradnak az ún kémiai kapcsolatok.
Az a kémiai kötések nem egyformák: alapvetően az érintett atomok elektronikus jellemzőitől függenek. A linkeknek két leggyakoribb típusa van: ionos kötések és a kovalens kötések.
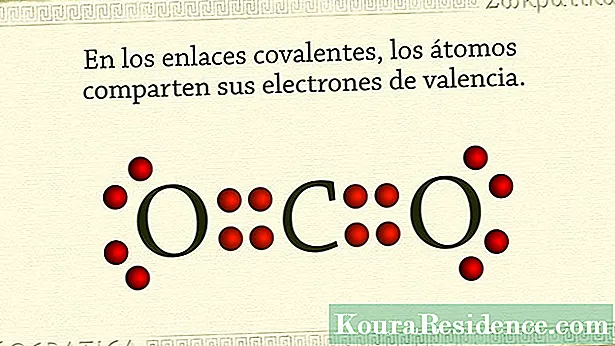
Jellemzően a kovalens kötések azok, amelyek nem fémes atomokat tartanak együtt. Előfordul, hogy ezen elemek atomjainak legkülső héjában sok elektron van, és hajlamosak elektronokat visszatartani vagy nyerni, ahelyett, hogy feladnák őket.
Ezért ezeknek az anyagoknak vagy kémiai vegyületeknek a módjaAz ikók a stabilitás elérése egy elektronpár megosztása révén történik, unem minden atomból. Ily módon a megosztott elektronpár közös a két atomnál, és ugyanakkor összetartja őket. Ban,-ben gázok nemesek, például ez történik. Halogén elemekben is.
Amikor a kovalens kötés hasonló elektronegativitású elemek, például hidrogén és szén között jön létre, kötés keletkezik apoláris kovalens. Ez történik például szénhidrogéneknél.
Ugyanígy a homonukleáris molekulák (ugyanabból az atomból állnak) mindig képződnek apoláris kötések. De ha a kötés különböző elektronegativitású elemek között jelentkezik, akkor az egyik atomban nagyobb elektronsűrűség keletkezik, mint a másikban, ennek eredményeként egy pólus képződik.
A harmadik lehetőség az, hogy két atomnak van egy pár elektronja, de ezekhez a közös elektronokhoz csak egy atom járul hozzá. Ebben az esetben beszélünk datatív vagy koordináta kovalens kötés.
A datatív link Szüksége van egy olyan elemre, amelynek szabad elektronpárja van (például nitrogén), és egy másikra, amely elektronhiányos (például hidrogén). Szükség van arra is, hogy az elektronikus párral rendelkező ember elég negatív legyen ahhoz, hogy ne veszítse el az elektronokat a megosztásra. Ez a helyzet például ammóniumban (NH4+).
Az anyagok kovalens vegyületeket tartalmazhat bármilyen anyagállapotban (szilárd, folyékony vagy gáznemű), és általában rossz hő- és villamosenergia-vezetők.
Gyakran mutatják viszonylag alacsony olvadás- és forráspont Y általában poláros oldószerekben oldódnak, mint a benzol vagy a szén-tetraklorid, de gyengén oldódnak a vízben. Rendkívül stabilak.
Számos példa adható kovalens kötéseket tartalmazó vegyületekre vagy anyagokra:
- Fluor
- Bróm
- Jód
- Klór
- Oxigén
- Víz
- Szén-dioxid
- Ammónia
- Metán
- Propán
- Szilícium-dioxid
- gyémánt
- Grafit
- Kvarc
- Szőlőcukor
- Paraffin
- Dízel
- Nitrogén
- Hélium
- Freon


